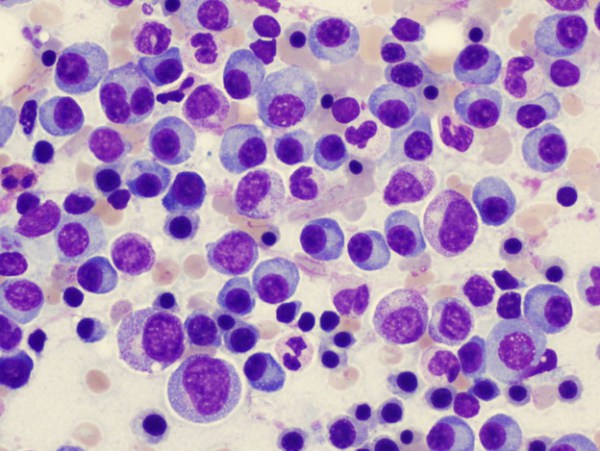
Η Amgen ανακοίνωσε ότι η Ευρωπαϊκή Επιτροπή ενέκρινε την επέκταση της ένδειξης για τη δενοσουμάμπη, για την πρόληψη των σκελετικών συμβαμάτων σε ενήλικες με προχωρημένου σταδίου κακοήθειες που εμπλέκουν τα οστά. Η ένδειξη πλέον καλύπτει ασθενείς με οστικές μεταστάσεις από συμπαγείς όγκους καθώς και αυτούς με πολλαπλό μυέλωμα. Η έγκριση βασίζεται στα δεδομένα της μελέτης ‘482 Φάσης ΙΙΙ, τη μεγαλύτερη διεθνή κλινική μελέτη που διεξήχθη ποτέ για την πρόληψη των σκελετικών συμβαμάτων σε ασθενείς με πολλαπλό μυέλωμα.
Ο David M. Reese, M.D., αντιπρόεδρος του τμήματος Translational Sciences και Ογκολογίας της Amgen, δήλωσε: «Πολλοί ασθενείς με πολλαπλό μυέλωμα εμφανίζουν οστικές βλάβες κατά τη διάγνωση, οι οποίες μπορούν να προκαλέσουν σοβαρές και καταστροφικές επιπλοκές, όπως οστικά κατάγματα, την ανάγκη για χειρουργείο ή ακτινοθεραπεία στα οστά καθώς και συμπίεση του νωτιαίου μυελού», και συμπλήρωσε λέγοντας: «Μέχρι τώρα, οι επιλογές αντιμετώπισης για την πρόληψη των οστικών επιπλοκών περιορίζονταν στα διφωσφονικά, τα οποία σε αντίθεση με τη δενοσουμάμπη, απομακρύνονται από τους νεφρούς και η χορήγηση των οποίων δύναται να συσχετιστεί με αυξημένη νεφρική τοξικότητα. Είμαστε ικανοποιημένοι με την επέκταση της ένδειξης για τη δενοσουμάμπη στην Ευρώπη, ένα γεγονός που καταδεικνύει την αφοσίωσή μας στη βελτίωση της περίθαλψης των ασθενών με πολλαπλό μυέλωμα».
Στη μελέτη ‘482 Φάσης ΙΙΙ, η δενοσουμάμπη πέτυχε το πρωταρχικό καταληκτικό σημείο, δηλαδή την χρονική παράταση έως την εκδήλωση του πρώτου σκελετικού συμβάματος σε ασθενείς με πολλαπλό μυέλωμα (ΑΚ = 0,98, 95% ΔΕ: 0,85 – 1,14). Ο μέσος χρόνος έως το πρώτο σκελετικό σύμβαμα που εκδηλώθηκε κατά τη διάρκεια της μελέτης ήταν 22,8 μήνες για το σκέλος της δενοσουμάμπης και 24,0 μήνες για το σκέλος του ζολεδρονικού οξέος. Το προφίλ ασφαλείας περιλάμβανε τις γνωστές ανεπιθύμητες ενέργειες της δενοσουμάμπης.
Η δενοσουμάμπη είναι το πρώτο ανθώπινο μονοκλωνικό αντίσωμα που προσδένεται και αδρανοποιεί το συνδέτη του RANK (RANKL) – μια βασική πρωτεΐνη για το σχηματισμό, τη λειτουργία και την επιβίωση των οστεοκλαστών, των κυττάρων που ευθύνονται για την οστική αποδόμηση – αναστέλλοντας έτσι την καταστροφή των οστών. Στις 5 Ιανουαρίου του 2018, ο Οργανισμός Τροφίμων και Φαρμάκων (FDA) των Η.Π.Α. ενέκρινε τη συμπληρωματική Αίτηση Αδειοδότησης Βιολογικών Παραγόντων για τη δενοσουμάμπη, ώστε να επεκταθεί η ήδη εγκεκριμένη ένδειξη για την πρόληψη των σκελετικών συμβαμάτων σε ασθενείς με οστικές μεταστάσεις από συμπαγείς όγκους, ώστε να περιλαμβάνει και τους ασθενείς με πολλαπλό μυέλωμα. Επιπρόσθετες ρυθμιστικές αιτήσεις για τη δενοσουμάμπη, για την πρόληψη των σκελετικών συμβαμάτων σε ασθενείς με πολλαπλό μυέλωμα, προετοιμάζονται ή έχουν ήδη κατατεθεί στις υγειονομικές υπηρεσίες σε παγκόσμιο επίπεδο.
Η έγκριση από την ΕΕ παρέχει μια κεντρική άδεια κυκλοφορίας με ενιαία σήμανση στα 28 κράτη μέλη της Ευρωπαϊκής Ένωσης (ΕU). Η Νορβηγία, η Ισλανδία και το Λιχτενστάιν, ως μέλη του Ευρωπαϊκού Οικονομικού Χώρου, θα λάβουν αποφάσεις ανάλογες με αυτήν της ΕE.